Sintesi riepilogativa del report TFOS DEWS II (Tear Film and Ocular Surface Society Dry Eye Workshop II)
SALUTE OCULARE

Introduzione alla Sindrome dell’Occhio Secco (DED) e relativa classificazione
“L’Occhio Secco è una malattia multifattoriale della superficie oculare caratterizzata da una perdita di omeostasi del film lacrimale e accompagnata da sintomi oculari, in cui l’instabilità e l’iperosmolarità del film lacrimale, l’infiammazione e le lesioni della superficie oculare e le anomalie neurosensoriali svolgono ruoli eziologici.”1
Classificazione della DED
La DED viene classificata in base alla relativa fisiopatologia, in cui l’Occhio Secco da deficit acquoso (ADDE) e l’Occhio Secco da deficit lipidico (EDE) coesistono all’interno di un continuum e quindi ogni elemento può essere preso in considerazione per la diagnosi e la gestione della DED.1
Figura 1: Classificazione della DED1
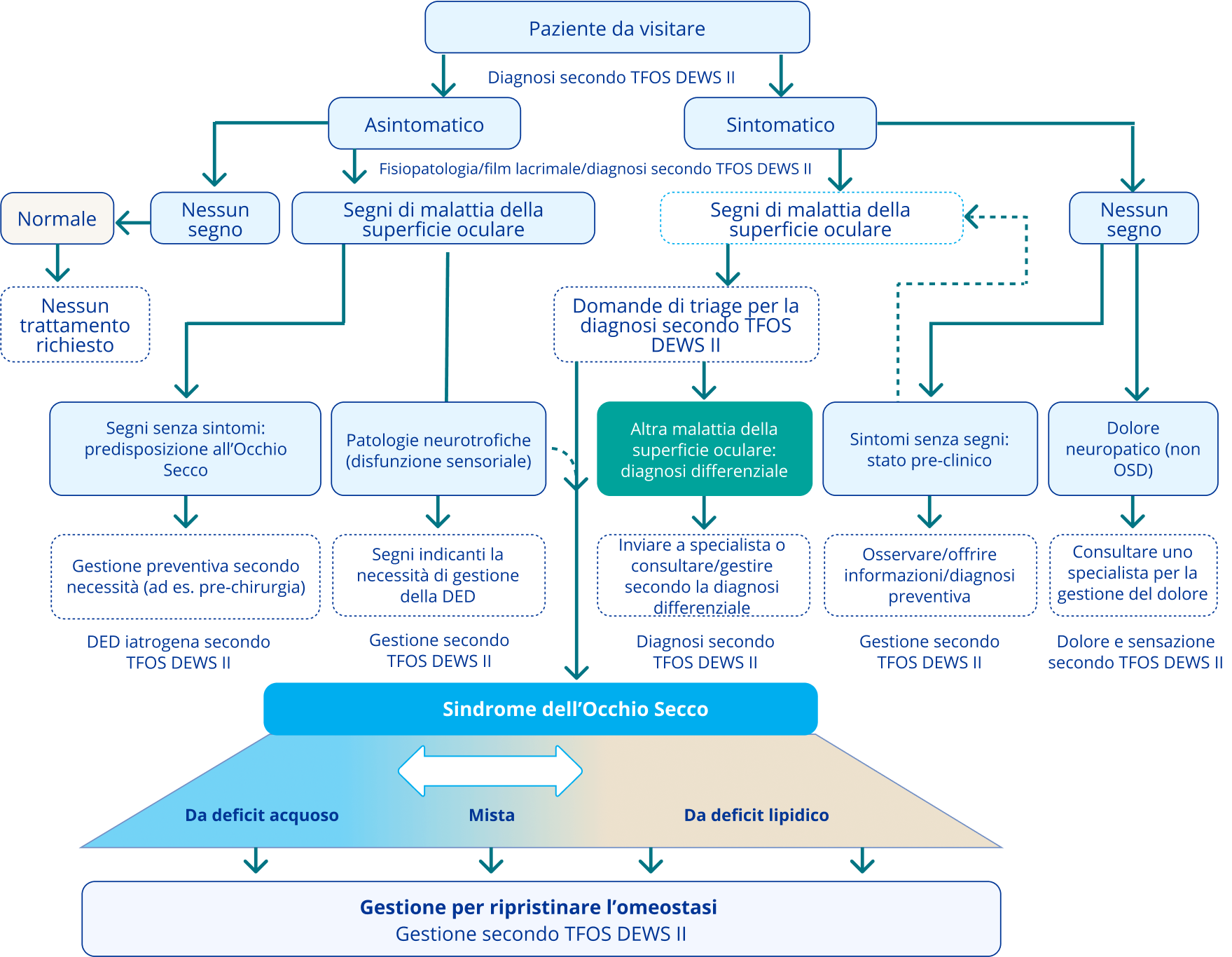
La parte superiore della figura rappresenta un algoritmo per le decisioni cliniche, che inizia con la valutazione dei sintomi e prosegue con un esame volto a individuare eventuali segni di una malattia della superficie oculare.1
La parte inferiore rappresenta la classificazione eziologica della DED, incentrata su i due tipi principali (ADDE ed EDE), e delinea lo scenario non reciprocamente esclusivo dell’Occhio Secco misto.1
Epidemiologia
Prevalenza della DED con e senza sintomi – 5-50%.1
Nelle donne sono riportati tassi di DED più elevati rispetto agli uomini. Tuttavia, la differenza diventa significativa soltanto all’aumentare dell’età.1
Fattori di rischio
I fattori di rischio della DED sono stati classificati nelle seguenti categorie:1

Fattori di rischio
consistenti
- Età
- Sesso
- Origine etnica
- Disfunzione delle ghiandole di Meibomio
- Malattia del tessuto connettivo
- Sindrome di Sjögren
- Deficit androgenico
- Uso del computer
- Uso di lenti a contatto
- Terapia estrogenica sostitutiva
- Trapianto di cellule staminali ematopoietiche
- Condizioni ambientali quali inquinamento, scarsa umidità e sindrome dell’edificio malato
- Farmaci quali antistaminici, antidepressivi, ansiolitici e isotretinoina

Fattori di rischio
probabili
- Diabete
- Rosacea
- Infezione virale
- Malattia tiroidea
- Disturbi psichiatrici
- Pterigio
- Scarso apporto di acidi grassi
- Chirurgia refrattiva
- Congiuntivite allergica
- Farmaci quali anticolinergici, diuretici e β-bloccanti

Fattori di rischio
inconclusivi
- Etnia ispanica
- Menopausa
- Acne
- Sarcoidosi
- Tabagismo
- Alcol
- Gravidanza
- Blefarite da Demodex
- Iniezione di tossina botulinica
- Multivitaminici
- Contraccettivi orali
Sesso, genere e ormoni
Il report TFOS DEWS II su sesso, genere e ormoni fornisce alcune indicazioni sulle numerose differenze legate al sesso che esistono a livello oculare e che possono essere ricondotte agli effetti degli steroidi sessuali (androgeni ed estrogeni), degli ormoni ipotalamo-ipofisari, dei glucocorticoidi, dell’insulina, del fattore di crescita insulino-simile e degli ormoni tiroidei.1
Inoltre, le differenze legate al sesso possono essere associate al complemento del cromosoma sessuale, che comprende le differenze relative agli effetti del genitore d’origine, al dosaggio dei geni del cromosoma X (ad esempio, l’inattivazione dell’X), ai geni della regione non ricombinante del cromosoma Y,ai fattori autosomici sesso-specifici e all’epigenetica (microRNA, metilazione e acetilazione del DNA, modificazioni istoniche).1
Il genere e il sesso biologico svolgono un ruolo importante nel rischio di DED, nella presentazione della malattia, nelle risposte immunitarie, nel dolore, nei comportamenti associati alla ricerca di cure, nell’utilizzo dei servizi e in vari altri parametri della salute oculare.1
Fisiopatologia e meccanismo
Il meccanismo centrale della DED è l’iperosmolarità lacrimale indotta dall’evaporazione, che è una caratteristica distintiva della patologia. La superficie oculare viene danneggiata direttamente e tramite l’attivazione dell’infiammazione.1
I due tipi principali di DED comprendono l’ADDE e l’EDE. Nell’ADDE, l’iperosmolarità lacrimale si manifesta quando la secrezione lacrimale è ridotta in condizioni di normale evaporazione. Al contrario, l’iperosmolarità presente nell’EDE è causata da un’eccessiva evaporazione in presenza di una normale funzionalità della ghiandole lacrimali.1
Figura 2: Fisiopatologia della Sindrome dell’Occhio Secco2-4
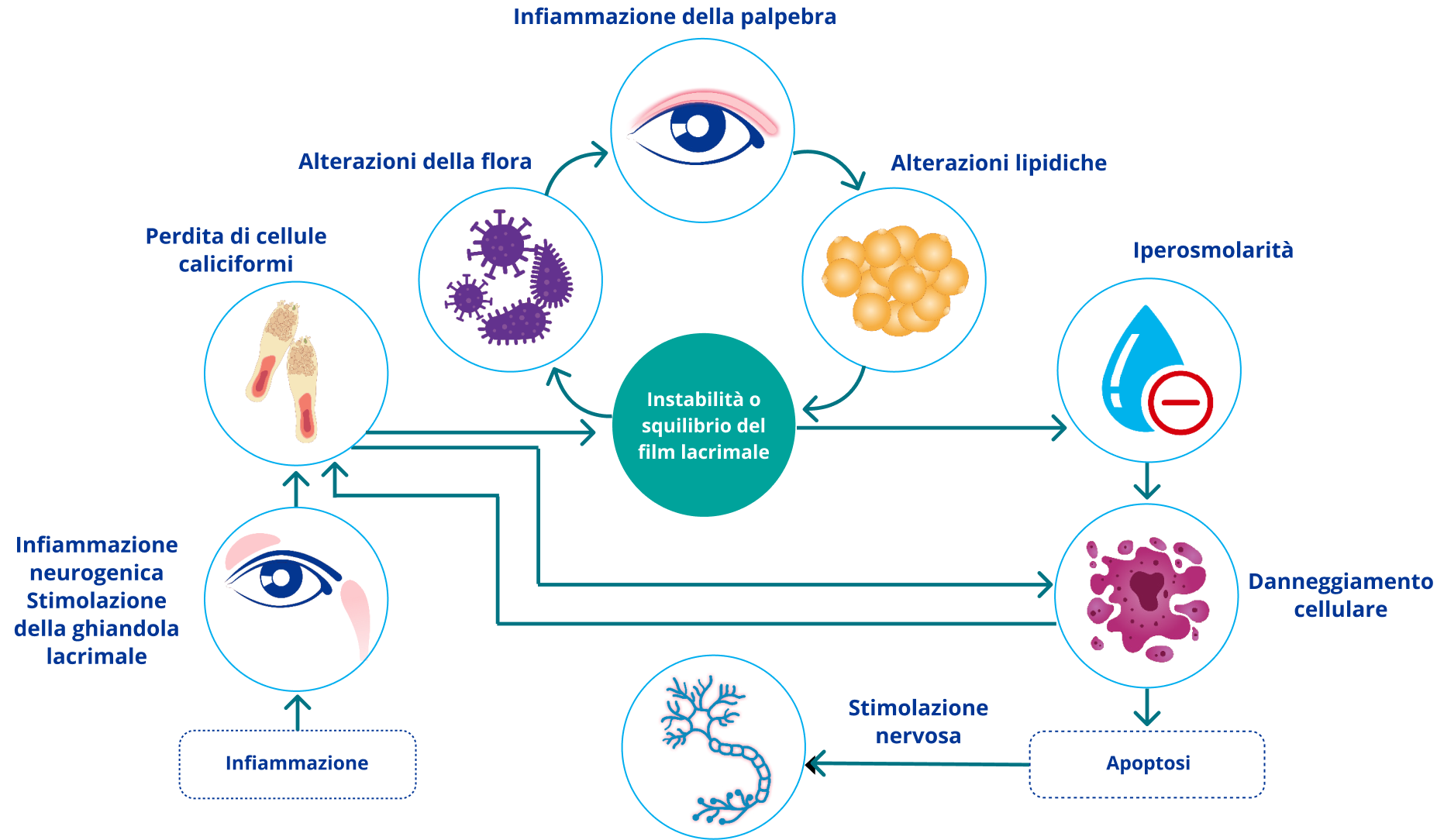
Il film lacrimale
Il film lacrimale è composto da uno strato lipidico che ricopre una fase muco-acquosa. È plausibile che le interazioni dell’intero film lacrimale, che contiene lipidi, mucine, proteine e sali, impediscano l’evaporazione e il cedimento.1
Lo strato muco-acquoso contiene quattro mucine principali e oltre 1500 tipi di proteine e peptidi. Anche se le proteine lacrimali variano nelle lacrime dei pazienti con DED, non è ancora stato validato un insieme di proteine che possa aiutare nella diagnosi.1
È necessario un approccio olistico per capire a fondo la struttura e la funzione del film lacrimale e per offrire un trattamento migliore ai pazienti con DED.1
Dolore e sensazione
Il dolore può essere classificato come dolore nocicettivo o dolore neuropatico.1
Il dolore nocicettivo insorge in risposta a un danneggiamento reale o incombente dei tessuti, mentre il dolore neuropatico è provocato da una lesione del sistema nervoso somatosensoriale.1
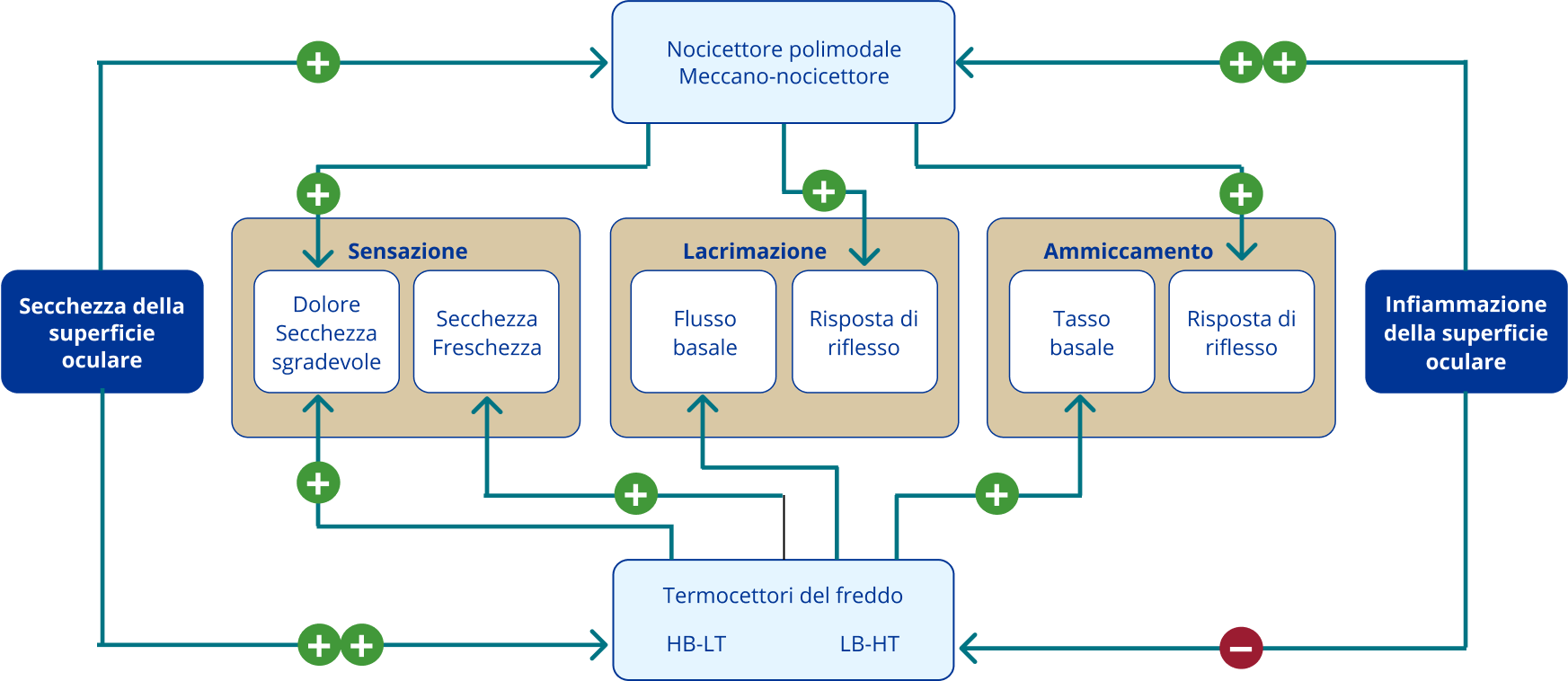
Il dolore causato dalla DED viene trasmesso attraverso gli assoni periferici dei neuroni del ganglio trigeminale, che innerva la cornea e la congiuntiva. I nervi sensoriali appartengono ai neuroni nocicettori polimodali, meccano-nocicettori puri e termocettori del freddo.1
I nocicettori polimodali rispondono a stimoli chimici, meccanici e termici, e vengono sensibilizzati dai mediatori infiammatori rilasciati durante le lesioni. Il membro 1 della sottofamiglia V del canale cationico con recettore a potenziale transitorio (TRPV1) svolge un ruolo fondamentale nella trasduzione sensoriale e nella sensibilizzazione dei nocicettori polimodali.1
I meccano-nocicettori puri rispondono soltanto alle forze meccaniche attraverso il gene piezo2 e altri canali di trasduzione non identificati, mentre i termocettori del freddo scaricano continuamente impulsi nervosi alla normale temperatura della superficie oculare, rispettivamente aumentando o diminuendo la frequenza di trasmissione basale con il freddo o il caldo. Il principale canale di trasduzione del freddo è il recettore a potenziale transitorio melastatina 8 (TRPM8) che è sensibile all’aumento dell’osmolarità.1
Dalla superficie oculare, i neuroni del ganglio trigeminale proiettano principalmente verso due regioni spazialmente discrete all’interno del complesso nucleare trigeminale del tronco encefalico: la regione di transizione tra Vi e Vc caudale (transizione Vi/Vc) e la regione di giunzione tra Vc e midollo cervicale superiore (regione Vc/C1). La ricerca suggerisce che la regione Vc/C1 svolge un ruolo determinante negli aspetti sensoriali-discriminanti del dolore oculare.1
Figura 3: L’infiammazione oculare di varia eziologia o l’essiccazione della superficie oculare nella DED provoca aumenti (+) o diminuzioni (-) variabili dell’attività di impulsi nervosi nei nocicettori polimodali, nei meccano-nocicettori e nei termocettori del freddo di tipo alto background-bassa soglia (HB-LT) e basso background-alta soglia (LB-HT)1
L’Occhio Secco iatrogeno
La DED può essere causata da una varietà di interventi iatrogeni, tra cui farmaci topici e sistemici, uso di lenti a contatto e procedure oftalmiche di tipo chirurgico e non chirurgico.1
I farmaci topici che causano la DED interagiscono con la superficie oculare esercitando effetti allergici, tossici e immunoinfiammatori, mentre i conservanti possono aggravare la DED a causa dei loro effetti tossici e proinfiammatori, nonché delle loro proprietà tensioattive detergenti.1
Inoltre, i farmaci sistemici possono anche indurre la DED secondaria alla riduzione della produzione lacrimale, all’alterazione dell’input nervoso e della secrezione riflessa, agli effetti infiammatori sulle ghiandole secretorie o all’effetto di irritazione diretta a causa di secrezione nelle lacrime.1
Il film lacrimale dei portatori di lenti a contatto affetti da DED subisce dalle alterazioni biofisiche che possono comprendere uno strato lipidico più sottile ed irregolare, l’instabilità del film lacrimale, un basso tasso di ricambio lacrimale basale e la diminuzione del volume del menisco lacrimale.1
Anche gli interventi chirurgici possono aggravare la DED a causa del tipo di procedura e dell’uso di farmaci topici post-operatori. Altri fattori di rischio per la DED iatrogena comprendono l’intervento di cataratta, le procedure chirurgiche alle palpebre, l’applicazione di tossina botulinica e le procedure cosmetiche.1
L’approccio diagnostico
Prima di diagnosticare la DED, è fondamentale escludere le patologie che imitano la DED con l’aiuto di un questionario. Successivamente, si possono svolgere gli esami consigliati per la diagnosi della DED.1
Figura 4: L’approccio diagnostico consigliato per la DED1
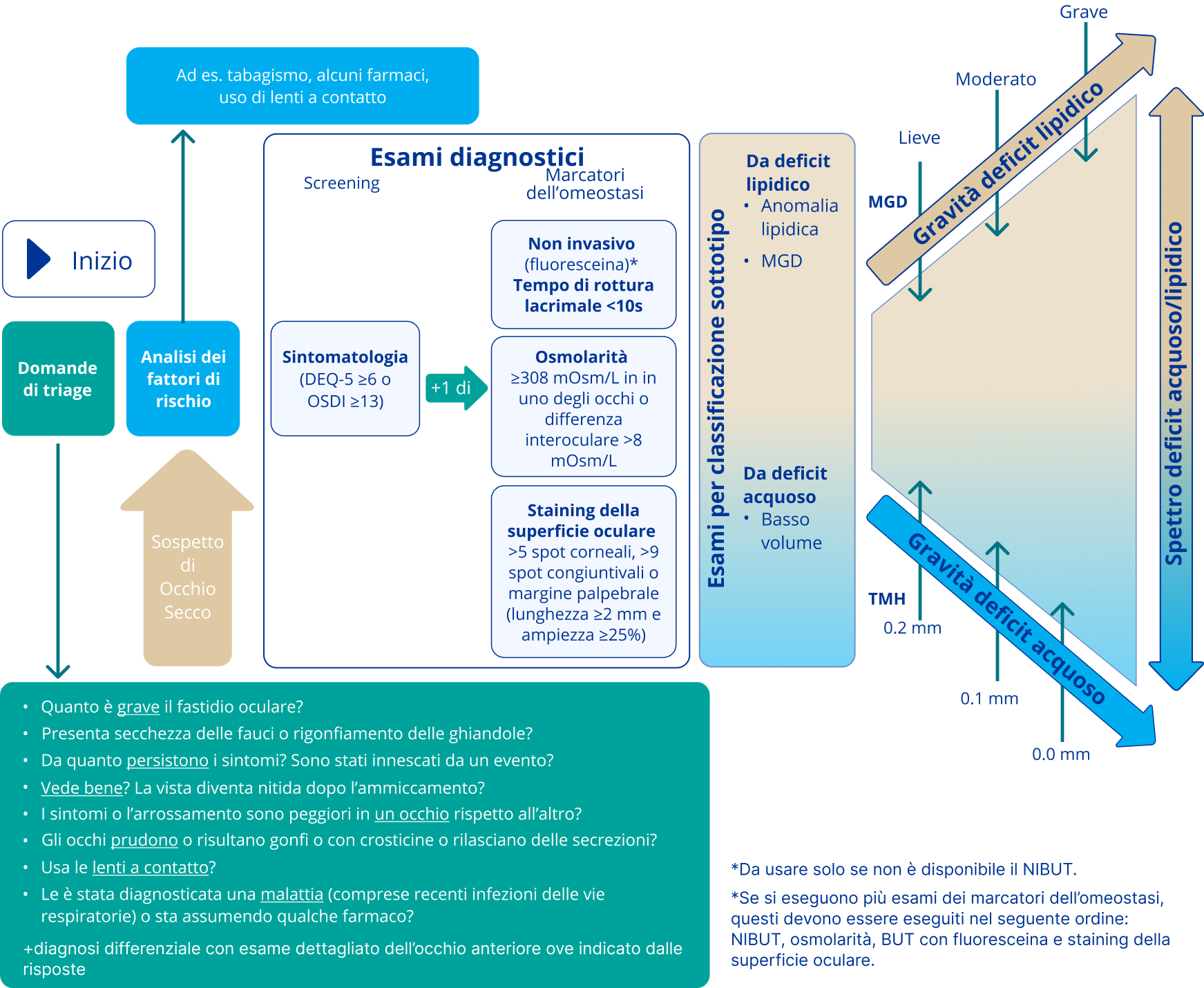
Una volta confermata la diagnosi di DED sulla base del punteggio positivo sui sintomi e di uno o più risultati positivi dei marcatori omeostatici, vanno condotti ulteriori esami, nello specifico meibografia, interferometria lipidica e misurazione del volume delle lacrime, per classificare e valutare la gravità della DED.1
Tabella: Approccio graduale alla gestione e al trattamento della DED1,a,b,c
Fase 1:
Informazioni sulla sua gestione, sul trattamento e sulla prognosi
Modifiche all’ambiente locale
Informazione circa le potenziali modifiche della dieta (tra cui l’integrazione orale di acidi grassi essenziali)
Identificazione e potenziale modifica/eliminazione di farmaci sistemici e topici dannosi
Lubrificanti oculari di vario tipo (se è presente la MGD, vanno presi in considerazione gli integratori lipidici)
Igiene palpebrale e impacchi caldi di vario tipo
Fase 2:
Se le opzioni sopraindicate sono inadeguate, considerare:
Lubrificanti oculari senza conservati per ridurre al minimo la tossicità indotta dai conservanti
Trattamento con olio di tea tree per Demodex (se presente)
Conservazione lacrimale
- Occlusione puntale
- Occhiali/occhialini a camera umida
Trattamenti notturni (quali unguenti o dispositivi a camera umida)
In ambulatorio, riscaldamento fisico e spremitura delle ghiandole di Meibomio (comprese terapie con dispositivo, come LipiFlow)
In ambulatorio, terapia con luce pulsata ad alta intensità per MGD
Farmaci su prescrizione per la gestione della DEDd
- Antibiotico topico o associazione di antibiotico/steroide applicati sui margini palpebrali per la blefarite anteriore (se presente)
- Corticosteroide topico (durata limitata)
- Secretagoghi topici
- Farmaci immunomodulatori non glucocorticoidei topici (come la ciclosporina)
- Farmaci antagonisti di LFA-1 topici (come il lifitegrast)
- Antibiotici macrolidici o tetracicline orali
Fase 3:
Se le opzioni sopraindicate sono inadeguate, considerare:
Secretagoghi orali
Collirio con siero autologo/allogenico
Opzioni per lenti a contatto terapeutiche
- Lenti morbide per bendaggio
- Lenti sclerali rigide
Fase 4:
Se le opzioni sopraindicate sono inadeguate, considerare:
Corticosteroide topico per una durata maggiore
Trapianti di membrana amniotica
Occlusione puntale chirurgica
Altri approcci chirurgici (ad es., tarsorrafia, trapianto di ghiandole salivari)
aSi riconoscono variazioni potenziali tra i pazienti all’interno dello spettro della malattia, e le opzioni di gestione sopraelencate non intendono essere esclusive. La gravità e l’eziologia dello stato della DED detteranno la gamma e il numero di opzioni di gestione da selezionare da una o più fasi.
bPossono essere prese in considerazione contemporaneamente una o più opzioni contenute nella stessa categoria entro la fase corrispondente dello stato della DED. Le opzioni di ogni categoria non sono classificate secondo l’importanza e possono risultare valide in ugual misura.
cVa notato che le evidenze disponibili a supporto delle varie opzioni di gestione variano e che saranno inevitabilmente inferiori per le opzioni di gestione più recenti. Pertanto, ogni opzione di trattamento va considerata in base al livello delle evidenze disponibili nel momento in cui si inizia la gestione.
dL’uso di farmaci su prescrizione deve essere considerato nel contesto della presentazione individuale del paziente e del livello relativo delle evidenze che ne supportano l’utilizzo per tale indicazione specifica, dal momento che questi agenti differiscono sensibilmente in termini di meccanismo d’azione.
Disegno delle sperimentazioni cliniche
Le misure elencate di seguito sono state consigliate per migliorare la qualità delle sperimentazioni cliniche, ottimizzare le risorse e ampliare le opportunità di nuove strategie terapeutiche per i pazienti con DED.1
- Le sperimentazioni cliniche devono seguire le Linee Guida di Buona Pratica Clinica.1
- I disegni degli studi, i trattamenti utilizzati e le dimensioni dei campioni devono essere compatibili con il trattamento sperimentale, con gli obiettivi dello studio e con la fase di sviluppo.1
- La dose di un farmaco o un agente biologico deve essere inferiore al livello tossico/non tollerato negli studi non clinici o nei precedenti studi clinici e deve anche essere sufficiente, per dose e frequenza, a erogare concentrazioni terapeutiche nel sito d’azione previsto.1
- La durata del trattamento deve essere adeguata al meccanismo d’azione e alla durata dell’effetto.1
Sintesi
L’Occhio Secco è una malattia multifattoriale della superficie oculare caratterizzata da una perdita di omeostasi del film lacrimale e accompagnata da sintomi oculari, in cui l’instabilità e l’iperosmolarità del film lacrimale, l’infiammazione e le lesioni della superficie oculare e le anomalie neurosensoriali svolgono ruoli eziologici.
- La DED si suddivide in ADDE ed EDE.
- La DED, con e senza sintomi, ha una prevalenza compresa tra il 5 e il 50% ed è più comune nelle femmine.
- I fattori di rischio della DED sono classificati come consistenti, probabili e inconclusivi.
- Il meccanismo della DED è l’iperosmolarità lacrimale indotta dall’evaporazione.
- Il principale obiettivo terapeutico nella gestione della DED è migliorare l’omeostasi della superficie oculare e del film lacrimale interrompendo il circolo vizioso della malattia.
Abbreviations:
ADDE, Aqueous Deficient Dry Eye; BUT, break-up time; DED, Dry Eye Disease; DEQ-5, 5-Item Dry Eye Questionnaire; EDE, Evaporative Dry Eye; GCP, Good Clinical Practice; HB-LT, high background, low threshold; LB-HT, low background, high threshold; LFA-1, Lymphocyte function-associated antigen 1; MGD, meibomian gland dysfunction; NIBUT, non-invasive tear break-up time; OSDI, Ocular Surface Disease Index; TFOS DEWS II, Tear Film and Ocular Surface Society Dry Eye Workshop II; TG, trigeminal ganglion; TMH, tear meniscus height; TRPM8, transient receptor potential melastatin 8; TRPV1, transient receptor potential cation channel subfamily V member 1.
Bibliografia:
1. Craig JP, Nelson JD, Azar DT, et al. TFOS DEWS II Report Executive Summary. Ocul Surf. 2017;15(4):802-812.
2. Baudouin C. A new approach for better comprehension of diseases of the ocular surface. J Fr Ophtalmol. 2007;30:239-246.
3. Baudouin C, Messmer EM, Aragona P, et al. Revisiting the vicious circle of dry eye disease: a focus on the pathophysiology of meibomian gland dysfunction. Br J Ophthalmol. 2016;100:300-306.
4. Baudouin C, Aragona P, Van Setten G, et al. ODISSEY European Consensus Group. Diagnosing the severity of dry eye: a clear and practical algorithm. Br J Ophthalmol. 2014;98:1168-1176.
